医疗器械服务
中国注册
• 米赫CFDA注册服务流程根据《医疗器械注册管理办法》等相关国内法律法规,米赫的注册咨询团队经验丰富,和国内相关药监部门保持和良好的联系,配合企业顺利完成各种类型产品的国内注册。
• 米赫服务项目
1.医疗器械产品首次注册
2.医疗器械产品重新注册
3.医疗器械产品注册证书变更
• 米赫服务依据
1.《医疗器械监督管理条例》(国务院令第650号)
2.《医疗器械注册管理办法》(国家食品药品监督管理总局第4号令)
• 米赫服务内容
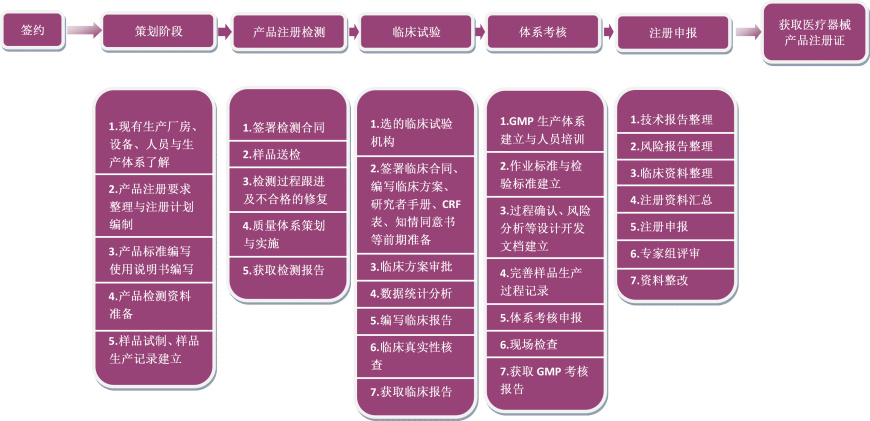
为协助企业按照相关法规要求完成医疗器械产品的临床试验及注册,缩短产品入市时间,我们可提供相应的咨询服务,内容包括:
- 协助产品注册费用预算、工作计划制定和跟进;
- 指导确定产品分类和注册审批程序;
- 协助医疗器械产品标准编写;
- 协助企业完成产品的注册检验和产品自测;
- 协助开展临床试验或准备临床资料(如:临床试验方案、临床须知、伦理审批、临床数据统计分析整理、编写临床报告等);
- 指导企业完成注册技术资料的编写(包括产品技术报告、风险管理报告、软件验证、灭菌验证报告等);
- 指导建立并有效实施医疗器械生产质量管理体系;
- 指导申请并通过质量管理体系或GMP考核;
- 指导产品注册相关资料的准备;
- 指导对补充材料通知内容的完善。
• 米赫服务流程