医疗器械服务
单一审核MDSAP
• 服务简介MDSAP医疗器械单一审核程序(Medical Device Single Audit Program)基于美国、加拿大、澳大利亚、巴西和日本等五个国家的医疗器械管理法规而构建而成,在ISO 13485的基础上,充分覆盖美国FDA QSR820、巴西RDC16:2013,以及日本、加拿大、澳大利亚等国的医疗器械质量体系法规要求,并兼容上述五国主管当局关于医疗器械的其他适用要求,如器械注册、售后监督、不良事件报告、产品召回等,目前该项目已经获得美国食药品监督管理局FDA、加拿大卫生局Health Canada、澳大利亚TGA、巴西卫生局ANVISA和日本厚生劳动省MHLW的认可。目前适用于五个参与国——美国、澳大利亚、巴西、加拿大、日本。
• 米赫服务项目
单一审核程序MDSAP文件的编写
• 米赫服务依据
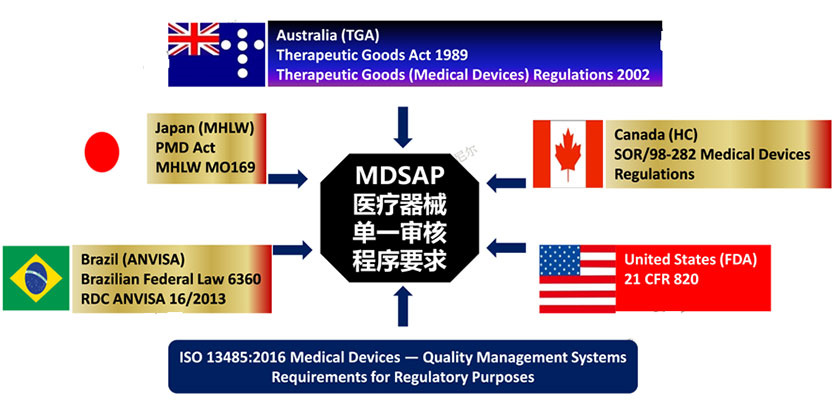
• 米赫服务内容
- 风险管理报告的融合
- 完整的反馈系统(含反馈&投诉&监督&报告&召回等)
- 产品设计与过程设计
- 设计变更与设计开发持续合规
- 环境要求与内务管理等
• 米赫服务流程
识别要求-实施培训-策划过程-建立体系-运行体系-测量、分析、改进-取得MDSAP证书


